コムギZIP遺伝子ファミリーのゲノムワイドな同定と植物におけるTaZIP13-Bの機能特性評価
コムギZIP遺伝子ファミリーのゲノムワイドな同定と植物におけるTaZIP13-Bの機能特性評価
Genome-Wide Identification of Wheat ZIP Gene Family and Functional Characterization of the TaZIP13-B in Plants
Song Li, Zihui Liu, Linlin Guo, Hongjie Li, Xiaojun Nie, Shoucheng Chai and Weijun Zheng* (李松霖、劉子姫、郭林林林、李紅傑、聶暁軍、蔡守正、鄭維軍
中国ヤンリン市西北工科大学農学院乾燥地作物ストレス生物学国家重点実験室
Front. Plant Sci. 12:748146. doi: 10.3389/fpls.2021.748146
(要旨)
ZIP (Zn-regulated, iron-regulated transporter-like protein) トランスポーターは、植物における微量元素の取り込み、輸送、蓄積を制御する重要な役割を担っている。小麦の ZIP 遺伝子を同定した研究もあるが、このファミリーの意義、特に鉄や亜鉛のストレスにおけ る関与はよく分かっていない。本研究では、コムギのZIPファミリーをゲノムレベルで網羅的に解析し、3つのTaZIP遺伝子については酵母の相補解析により、TaZIP13-Bについてはシロイヌナズナの遺伝子導入により機能検証を行った。最新のコムギ文献(IWGSC_V1.1)とのゲノムワイド検索により、合計58個のTaZIP遺伝子が同定された。これらの遺伝子は系統解析により3つのグループに分類され、同じグループ内の遺伝子はエキソン-イントロン構造や保存モチーフの構成が類似していることがわかった。発現パターン解析の結果、TaZIP遺伝子の多くは根で高発現し、9つのTaZIP遺伝子は登熟期で高発現することがわかった。また、ZnSO4溶液およびFeCl3溶液に曝された場合、TaZIP遺伝子は発現パターンに差異が見られた。さらに、6つのZIP遺伝子は亜鉛・鉄欠乏に応答した。標的の関係から(? based on the target relationship)合計 57 の miRNA TaZIP 相互作用が構築され、3 つの miRNA が ZnSO4 および FeCl3 ストレスに曝されるとダウンレギュレーションされることがわかった。酵母の相補性解析により、TaZIP14-B, TaZIP13-B, TaIRT2-A が Zn と Fe を輸送することが証明された。また、TaZIP13-B をシロイヌナズナで過剰発現させたところ、野生型シロイヌナズナより鉄・亜鉛ストレスに強く、種子中に多くの金属元素を濃縮できることが示された。
本研究は、小麦のゲノム構成、遺伝子構造、発現プロファイル、制御ネットワーク、およびZIPファミリーの生物学的機能を系統的に解析し、TaZIPの制御的役割の理解を深め、小麦作物の栄養品質向上に貢献するものである。
(まえがき) 省略
(実験方法) 省略
(実験結果) 省略
(論議)
亜鉛と鉄は、植物の発育に不可欠な微量元素である。亜鉛と鉄が不足すると、落葉、萎れ、さらには枯死することもある(Vert et al.、2001)。植物が亜鉛を欠乏させる主な原因は、亜鉛と鉄の量が少ない土壌にあります(Almendros et al.) 世界の農地面積の約30%がZn欠乏であり、穀物収量と穀物中のZn濃度の両方に影響を及ぼしています(Paul, 2015)。環境から持続的にZnを取り込むために、植物はZIP(transporter like protein; Eide, 2006)と呼ばれる高親和性と低親和性のZnトランスポーターを含むデュアルトランスポーターシステムを持っています。このタンパク質ファミリーは、シロイヌナズナ、イネ、オオムギ、トウモロコシ、コムギなど多くの種で報告されている(Bugghio et al., 2002; Pedas et al., 2008; Li et al., 2013; Tiong et al., 2015; Evens et al., 2017)。先行研究では、小麦で42のZIP遺伝子が同定されているが、多くのZIP遺伝子はまだ同定されていない(Tiong et al., 2015; Evens et al., 2017)。本研究では、これまでに同定された42のZIP遺伝子を含む58のZIP遺伝子をコムギで同定した。さらに、特定の組織とZnSO4/FeCl3処理下の両方で発現パターンを解析した。また、ZIP遺伝子の構造とTaZIPのモチーフを解析した。これらの遺伝子は、5番染色体を除くすべての染色体上に分布していた。ZIP遺伝子の局在は不均一であり、これは多倍体化の際にTaZIPが特異的に保持され、分散したためと考えられる。小麦のZIP遺伝子の配列長は大きく異なり、IIIとIVの間の膜貫通ドメインは変化しうる(Guerinot, 2000)。ほとんどのTaZIPsタンパク質の細胞内局在は、膜上に位置すると予測された。この結果は、ZmZIPs、AtZIPs、HvZIPsの結果と一致した(Lin et al., 2009; Li et al., 2013; Tiong et al., 2014)。細胞膜に存在する植物タンパク質は、環境からZnやFeを素早く同化することができるため、細胞膜はZnやFeの輸送に重要な領域である(Schneider, 1983)。液胞膜には他にもAtZIP1やOsZIP6などのZIPタンパク質が存在する。 miRNAは転写後の植物タンパク質の発現量を調節するのに重要な役割を果たす調節因子である(Vaucheret, 2006)。そこで、miRNA と標的遺伝子のネットワークを構築したところ、tae-miR164 と tae-miR5084 が最も多くの標的遺伝子を持つことが分かった。この 2 つの miRNA は TaIRT 遺伝子を標的としており、特に tae-miR164 は TaIRT1-A と TaIRT2-A, B, D を標的としていることから、 tae-miR164 と tae-miR5084 がそれぞれ環境からの鉄の取り込みと濃縮に重要な役割を果たす可能性が示唆され た。TaZIP遺伝子の多くは主に根で発現しているが、葉や茎で発現しているものもある。今回の結果から、ほとんどのTaZIP遺伝子が根で発現することで、ZnやFeの吸収・輸送に役立っていることが明らかになりました。いくつかの研究により、ZnとFeは主に根で吸収され、葉面トロピックモードで異なる組織に運ばれることが明らかにされている(Yamaji and Ma, 2014)。穀物中のZnとFeの含有量は、小麦の品質を測る最も重要な指標の1つである(Ziaeian and Malakouti, 2001)。Zn と Fe の蓄積は、通常、穀物充填期に穀物内に発生する(Tavarez et al.、2015)。いくつかの研究では、ミネラル不足がZIP遺伝子の過剰発現を誘導することが実証されている(Li et al.、2013)。他の研究では、穀物におけるZnおよびFe含有量とZIP遺伝子の過剰発現の関係を報告している(Lee and An, 2009; Tiong et al, 2014)。本研究では、穀物充填期に9つの遺伝子が発現上昇したことから、これらの遺伝子が穀物のZnとFeの蓄積に関与している可能性が高いことがわかった。TaIRT2の発現量はアップレギュレートされ、TaIRT1の発現量はダウンレギュレートされており、これはOsIRT1およびOsIRT2(Nakanishi et al.、2010)と同様であった。多くの植物において、IRT1とIRT2は異なる輸送基質を持ち、植物の成長段階における発現パターンも異なる(Vertら、2001;Pedasら、2008)。ほとんどのZIP遺伝子は、Zn-およびFe-欠乏条件下で発現が上昇する(Mäser et al., 2001; Mizuno et al., 2008; Tiong et al., 2015; Evens et al., 2017)。シロイヌナズナではAtZIP1-5、AtZIP9-12、AtIRT3がZn欠乏処理により、イネではOsIRT1、OsIRT2が鉄欠乏処理により、小麦ではTaZIP3、-5、-7、-13がZn欠乏処理により誘導された(Evens et al.、2017年)。
シロイヌナズナではAtZIP1-5、AtZIP9-12、AtIRT3がZn欠乏処理により、イネではOsIRT1、OsIRT2が鉄欠乏処理により、小麦ではTaZIP3、-5、-7、-13がZn欠乏処理により誘導された(Evens et al.、2017)。ZIPトランスポーターは,高親和性Znトランスポーターと低親和性Znトランスポーターの二重トランスポーター系である(Sillanpaeae and AGL, 1982; Mizuno et al, 2008)。高親和性システムは約0.1μmol/Lで飽和し、低親和性システムは0.5から50μmol/Lの濃度で変化する線形関係を示す(Lee et al.、2010a,b)。小麦のZn取り込み系は二重系である(Reid et al., 1996)。本研究では、TaZIP 遺伝子の約半数が 0.05 μmol/L ZnSO4 処理で高発現し、その他は 0.5 μmol/L ZnSO4 処理で高発現することが示された。TaZIP遺伝子は、FeCl3溶液においても同様の発現パターンを示した。0.05 μmol/L FeCl3 で 19 種類の TaZIP が、0.5 μmol/L FeCl3 で 23 種類の TaZIP が高発現していた。ZIP 遺伝子の発現パターンは、Zn と Fe の処理濃度の違いで異なることが、以前の研究で明らかになっ ている。Zn 親和性に基づき、0.05 μmol/L ZnSO4 処理で最も発現量の多い 16 の TaZIP 遺伝子を高親和性 Zn トランスポーターとし、その他の TaZIP 遺伝子を低親和性 Zn トランスポーターと考えた。また、0.05μmol/Lおよび0.5μmol/L ZnSO4処理下で4つのTaZIP(TaZIP18, TaZIP4-B, TaZIP29, TaIRT2-A)が発現を増加させていることを明らかにした。また、6 つの ZIP 遺伝子が Zn および Fe 欠乏条件下で発現上昇することを証明した。miRNAの制御的役割は、標的遺伝子の発現を抑制することであり、miRNAと標的遺伝子は相反する発現パターンを持つことを意味している(Zamoreら、2000;Bernsteinら、2001)。しかし、最近の研究では、miRNAは遺伝子の転写を活性化することもできることが示されてる(Xiao et al.、2017)。本研究では、ZnおよびFeストレス下での3つのmiRNAの発現を解析した。その結果、低濃度の ZnSO4 と FeCl3 では、3 種類の miRNA の発現が低下することが明らかになった。しかし、tae-miR5084 と tae-miR395a は 50μmol/L の ZnSO4 と FeCl3 で発現が増加した。過剰な Fe や Zn を吸収することは植物にとって毒であり、小麦は miRNA をアップレギュレートして TaZIP 遺伝子の発現を抑制している可能性がある。tae-miR399-A1を過剰発現させると、高リン水溶液中でTaPHO2- A1, B1, D1遺伝子の発現を抑制できるが、小麦は葉に多くのPiを蓄積する(Ouyang et al,2016)。本研究では、tae-miR5084とtae-miR395aは50μmol/L ZnSO4とFeCl3において共に発現が上昇し、標的遺伝子の発現を抑制していた。
酵母では、高親和性トランスポーター遺伝子(Zrt1)がZn欠乏培地でのZnの取り込みを担っている。Znが豊富な場合、Zrt1は抑制され、低親和性トランスポーター(Zrt2)がZnの取り込みを媒介する(Eide, 2006)。ZHY3はzrt1, zrt2遺伝子を欠損した変異体で、ZnSO4を含まないSD培地で生育できない。fet3fet4 DEY1453 もFeCl3を含まないSD培地で正常に生育できない変異体である。これらの変異体に機能する遺伝子を挿入することにより、この生育不全を回復させることができる。酵母の相補性は、ZIP遺伝子がzrt1zrt2とfet3fet4の二重変異体の成長欠陥を逆転できることを実証するために使用されている(Mäserら、2001年)。本研究では、TaZIP14-B, TaIRT2-A, TaZIP13-Bを酵母変異体に挿入し、酵母相補性アッセイにより、これらの遺伝子が生育障害を回復させることが実証された。この結果は、これら 3 つの遺伝子が Zn と Fe を効果的に輸送することを実証した。小麦のZIP遺伝子はいくつか研究されているが、これら3つの遺伝子は検証されていない(Evens et al., 2017)。植物は、有害金属を回避するために2つの方法を進化させてきた。1つは植物から金属を排除する方法、もう1つは特定のオルガネラに金属元素を濃縮する方法である。植物では、根が金属元素の取り込みを担当し、液胞がその排除と濃縮を担当している。このプロセスには、YSL遺伝子、CDF遺伝子、ZIP遺伝子が関与している(Colangelo and Guerinot, 2006)。ZIPトランスポーターは亜鉛と鉄を輸送する以外に、Cd、Ni、Mnなどの他の金属も輸送する。ZIPトランスポーターの多くは、発現すると根でZnやFeを濃縮するが、ZIP遺伝子の発現により茎や葉でもZnやFeを濃縮することがある(Salt et al.、1995)。植物では、鉄と亜鉛は動的にバランスをとっている。植物を高濃度の金属元素にさらすと、その細胞内のフリーラジカルの生成と消去のバランスが崩れ、活性酸素ラジカルが大量に生成され、膜中の不飽和脂肪酸の過酸化が誘導される。また、植物に重金属中毒を引き起こす(Bernstein et al., 2001; Breusegem and Dat, 2006; Zhao, 2007)。本研究では、3 種類の TaZIP13-B トランスジェニック系統と 1 種類の WT 系統を異なる濃度の FeCl3 溶液で処理したところ、WT の葉に褐色の斑点ができ、ほとんどの葉柄が枯死した。ZnSO4処理では、WTの葉は灰色になり、3つの過剰発現株は正常な状態を保った。重金属は、クロロフィル合成を阻害し、光合成に影響を与え、葉のクロロシスを誘発するため、主に植物に対して毒性がある(Breusegem and Dat, 2006)。OsIRT1 を過剰発現させた遺伝子組換え植物でも、鉄欠乏条件下で葉緑素が減少する (Lee and An, 2009)。本研究では、Fe および Zn 溶液に曝した場合、WT 株のクロロフィル含量は遺伝子組換え株よりも有意に低下することが示された。インドール-3-酢酸(IAA)は、側根の形成に関係するホルモンである。先行研究では,Cu および Cd ストレス下で IAA レベルが上昇したが,根ではコントロールと比較して有意な変化は見られなかった。Znストレスでは根の分岐が有意に増加した(Sfo et al.,2013)。本研究では,50μmol/L Zn/Fe ストレス下で IAA 濃度の上昇により根の分岐が増加し,側根形成が生じた。また,MS Zn-/Fe-条件下では,側根の数も増加した。これまでの研究で、PiおよびFe欠乏条件下でシロイヌナズナの側根が増加することが判明しているが(Rai et al., 2015)、Zn-またはFe欠乏がシロイヌナズナの側根の発達を促進することを証明する根拠はない。シロイヌナズナは、Pi、硝酸塩(N)、カリウム(K)、硫酸塩(S)欠乏の異なる組み合わせにさらされると、異なるパターンの根系構造を生成した(Kellermeier et al.、2014)。このことは、シロイヌナズナが複数の栄養欠乏を統合し、複雑な根の発達プログラムに変換する生得的な能力を持っていることを示している。ZnとFeは植物の成長に不可欠であり、植物の乾物蓄積に関係する。植物が生殖段階に達すると、その光合成産物は穀物に蓄積される。したがって、種子の大きさは植物の初期段階における乾物蓄積に関係する(Cock and Yosiida, 1972; Yoshida, 1972; Hirose et al, 2008)。
しかし、この種子サイズの増大は、植物体内での過剰発現によるものであり、種子に限定した発現によるものではない。このことは、種子肥大は葉などの植物体内での過剰発現によるものであることを示している(Hakata et al., 2012)。本研究では、シロイヌナズナの3つの過剰発現系統の種子がWT系統よりも大きかったことから、遺伝子導入系統のクロロフィル含量がWT系統よりも高いことが示唆された。また、植物組織中の Fe および Zn 含有量を検出した。これまでの研究で、ZmZIP7、ZmZIP3、ZmZIP5とZmIRT1を野生のシロイヌナズナとトウモロコシに導入すると、種子中のZnとFe含有量が向上することがわかっている(Li et al.、2013、2016、2019b)。その結果、過剰発現株では根と芽のFeとZnの含有量がWT株よりも濃縮され、特に種子でFe含有量が増加することが実証された。本研究により、TaZIP13-Bは遺伝子組換え系統においてFeおよびZnを濃縮・輸送し、種子中のFeおよびZn含量を向上させることができることが示された。
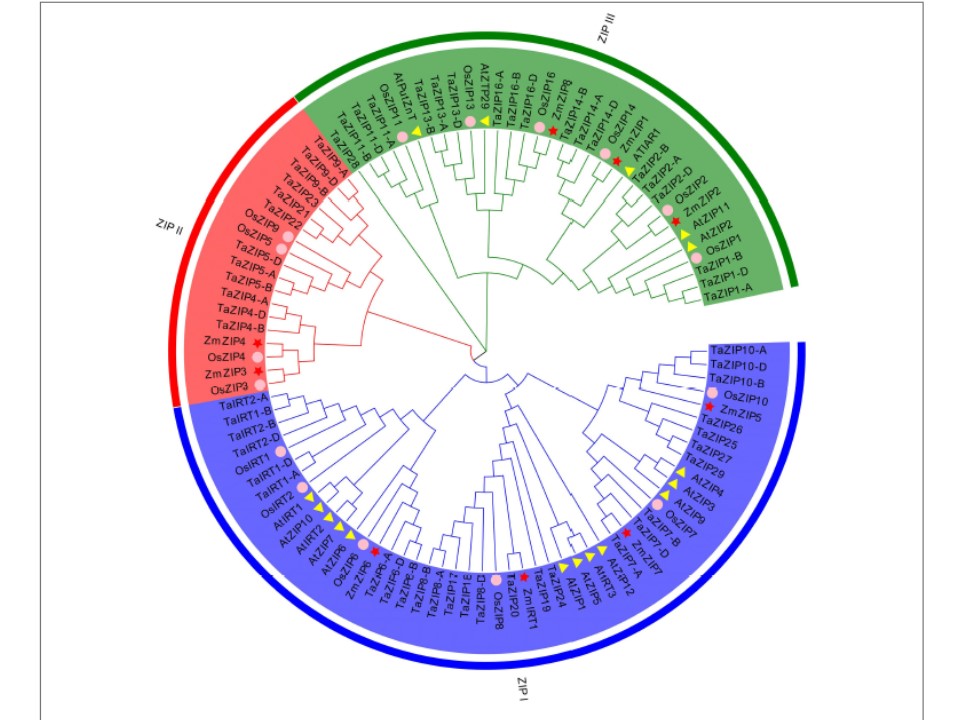
(下図の説明)
ZIP(Zn-regulated, iron-regulated transporter-like protein)タンパク質の系統樹(全長タンパク質配列に基づきneighborjoining法で作成)。3つの異なるグループは異なる色で示されている。イネ、シロイヌナズナ、トウモロコシのタンパク質は異なる形状で示されている。