ミニ総説:ユビキチンプロテアソームシステムと栄養ストレス応答
以下のプロテアソームの機能に関するミニレビューでは、鉄栄養に関する部分のみ翻訳した。
ミニ総説:ユビキチンプロテアソームシステムと栄養ストレス応答
The Ubiquitin Proteasome System and Nutrient Stress Response
Erin Mackinnon and Sophia L. Stone *
Department of Biology, Dalhousie University, Halifax, NS, Canada
Frontiers in Plant Science | www.frontiersin.org 1 May 2022 | Volume 13 | Article 867419
要旨
植物は、プロテオームの変化を促進するユビキチン・プロテアソーム・システム(UPS)を含む様々な分子機構を利用して、生長や発達に対する生物ストレスの影響を緩和している。
UPSは、特定の基質をユビキチン化し、その後、修飾されたタンパク質をプロテアソームで分解する機構を包含している。
ユビキチンリガーゼ(E3)は、基質タンパク質に1つまたは複数のユビキチン分子を結合させ、特異性を制御するため、UPSの中心的な役割を担っている。
最近の研究から、UPSは必須大栄養素や微量栄養素の取り込みや輸送の重要な制御因子であることが分かってきている。
本総説では、栄養の取り込みと、窒素、リン、鉄、銅の制限または過剰レベルを含むストレス条件に対する応答の制御に関与するE3について論じる。
鉄:
鉄は、クロロフィルの生合成、窒素固定、DNA の複製と修復、電子輸送鎖に必要である (Pushnik et al., 2008; Zhang, 2014)。過剰な鉄は根の成長を阻害し、他の栄養素の吸収に影響を与えるが、この問題は嫌気性・酸性土壌条件によって増大する(Becker and Asch, 2005)。鉄が不足すると、根では鉄輸送体1(IRT1)の発現が上昇し、根圏からの鉄の取り込みを促進する(Vert et al.、2002)。IRT1は、H+-ATPase2(AHA2)、Fe3+をFe2+に還元して取り込むFerric Chelate Reductase 2(FRO2)と細胞膜に局在する複合体を形成して、根圏を酸性化して鉄分を可溶化する(Connolly et al.) IRT1は、Zn、Mn、カドミウム(Cd)、コバルト(Co)など他の必須陽イオンも輸送している(Vert et al. 2002)鉄輸送体は、RING型E3 IRT1 Degradation Factor 1(IDF1)によって細胞膜でユビキチン化され、プロテアソームによるターンオーバーと同様に液胞分解に至るエンドサイトーシスを促進すると示唆されている(Barberon et al.、2011; Shin et al.、2013;Dubeaux et al.、2018)。Zn、Mn、Coなどの非鉄金属の濃度を上げると、IRT1のモノユビキチン化に続いて、63-リジン結合を用いたIDF1-仲介ポリユビキチン化により鎖を生成することが促進される(Barberonら、2011; Dubeauxら、2018)。モノユビキチン化およびポリユビキチン化の両方の修飾は、液胞での内在化および分解を促進することによって、細胞膜におけるIRTIのレベルを低下させる。過剰な非鉄金属に応答して、IDF1を介したユビキチン化への切り替えは、IRT1のCIPK23依存的なリン酸化によって引き起こされる(Dubeaux et al.、2018)。AHA2およびFRO2もユビキチン化されるが、この修飾は非鉄金属によって誘導されず、内在化および分解を促進しないが、酵素機能を調節することが示唆されている(Martín-Barranco et al, 2020)。FER様鉄欠乏誘発転写因子(FIT)は、IRTIや他の鉄欠乏応答性遺伝子の発現を制御する基本ヘリックスループヘリックス(bHLH)転写因子群の中の重要な制御因子である(Cohenら、2004;Maiら、2016)。鉄欠乏は、FITの発現と活性化を頂点とするbHLH制御因子のカスケードを引き起こし、鉄の動員および取り込みに関与する遺伝子の転写を促進する。2つのbHLH転写因子、bHLH105とbHLH115は、RING型E3 BRUTUS(BTS)によってユビキチン化されプロテアソーム分解の標的となり、ストレスのない状態で鉄欠乏反応の活性化を禁止する(Selote et al.、2015年)。Iron Mans(IMA)は、Fe欠乏下でBTSに結合し、bHLH105およびbHLH115との相互作用を破壊し、転写因子を蓄積させてストレス応答を促進するペプチドファミリーである(Grillet et al., 2018; Li et al., 2021)。BTSは、BRUTUS-LIKE1(BTSL1)およびBTSL2を含むヘメリトリン含有RING型E3のファミリーに属し、O. sativa Hemerythrin motif-containing RING- and Zinc-finger protein 1(OsHRZ1)および OsHRZ2(小林ら、2013; Rodríguez-Celma et al, 2019)に類似している。BTSL1およびBTSL2は、プロテアソーム依存性分解を介してFITの存在量を調節する(Rodríguez-Celma et al.、2019)。BTS、OsHRZ1、およびOsHRZ2は、FeおよびZnと結合することが示されており、E3が金属センサーとしてだけでなく、Fe欠乏応答の負のレギュレーターとして機能することが示唆されている(Kobayashi et al.) OsHRZ1およびOsHRZ2はまた、過剰な鉄ストレス下で金属の取り込みを制限するために必要であり、鉄感知におけるE3sの役割をさらに示唆している(Aungら、2018年)。RING型E3であるRing Domain Ligase1(RGLG1)およびRGLG2も、鉄制限条件への応答の制御に関与しているが、基質は不明である(Pan et al.、2015)。
結論
鉄や窒素などの栄養素の恒常性維持に関わるユビキチンを介したプロセスに関する知識は十分に確立されている。UPSは、根圏から栄養を取り込む細胞膜のトランスポーターの存在や、根から地上器官に栄養を移行させるトランスポーターの量を調節している。また、UPSは、栄養の恒常性維持に関わる遺伝子の転写を制御する制御因子のレベルも調節している。しかし、ホウ素、亜鉛、銅など、ほとんどの栄養素の取り込みを制御するUPSの機能についての理解は、非常に限られている。研究が進めば、ユビキチンを介した栄養素の感知、取り込み、移動の制御の範囲がより明らかになることは間違いない。また、ユビキチンリガーゼの活性や基質との結合を、さまざまな栄養条件下で制御するメカニズムについても、より深い理解が得られるかもしれない。気候変動を考慮すると、栄養素の獲得におけるユビキチン化の役割をより詳細に知ることは、生育や収穫に対する生物的・生物学的ストレスの悪影響を改善するために、最適な栄養状態を維持する方法の理解に役立つと思われる。
表1 栄養素吸収とストレス応答に関わるユビキチン酵素群
図1|(A)ユビキチン・プロテアソーム系の簡略化した概要。E1、E2およびE3酵素は、1つまたは複数のユビキチン(Ub)分子の標的基質への結合を促進する。標的のユビキチン化は、基質に結合する前にE2からE3活性システインにUbが移動する(i)か、基質にUbが直接移動する(ii)ことにより行われる。この結合カスケードにより、基質のモノユビキチン化(1カ所に1つのUb)、マルチユビキチン化(異なる部位に複数のUb)、ポリユビキチン化(複数のUbが鎖状になる)が生じる。ポリユビキチン化された基質は、26Sプロテアソームによって認識され分解される。Ubは基質から除去され、再利用される。(B)異なるE3タイプの模式図。E3はRING (Really Interesting New gene)、HECT (Homologous to E6AP C-terminus)、U-boxドメインを利用してE2と相互作用している。シングルサブユニットのHECTやRING-in-between-RING(RBR)タイプのE3は、E2からUbを受け取る。複合型E3 Culin (Cul)-RING ユビキチンリガーゼ (CRLs) は、E2と基質との相互作用に異なるサブユニットを利用する。
図2|シロイヌナズナとイネ由来のE3が栄養摂取を制御する役割を簡略化した図。(A)高窒素下では、E3 NLAがユビキチン依存的にNRT1.7硝酸トランスポーターを分解し、窒素の過剰蓄積を回避している。トランスレセプターNRT1.1BはE3 NBIP1を動員し、SPX4をユビキチン化して転写因子NLP3が核内に入り、窒素応答性遺伝子の発現を促進させることがわかった。(B)リン酸が豊富な環境では、E3 NLAが無機リン酸輸送体PHT1をユビキチン化し、26Sプロテアソームによる分解を促進し、リン酸の取り込みを抑制して過剰蓄積を防いでいる。リン酸制限ストレス条件下では、E3であるSDEL1とSDEL2がSPX4の分解を仲介し、転写因子PHR1/2がPHT1などのPSI遺伝子の発現を活性化することができる。また、E3であるPRU1が抑制因子WRKY6の分解を仲介し、PHO1の転写の抑制を緩和している。PHO1トランスポーターの存在量が増加すると、根の木部へのPiのロードが促進される。
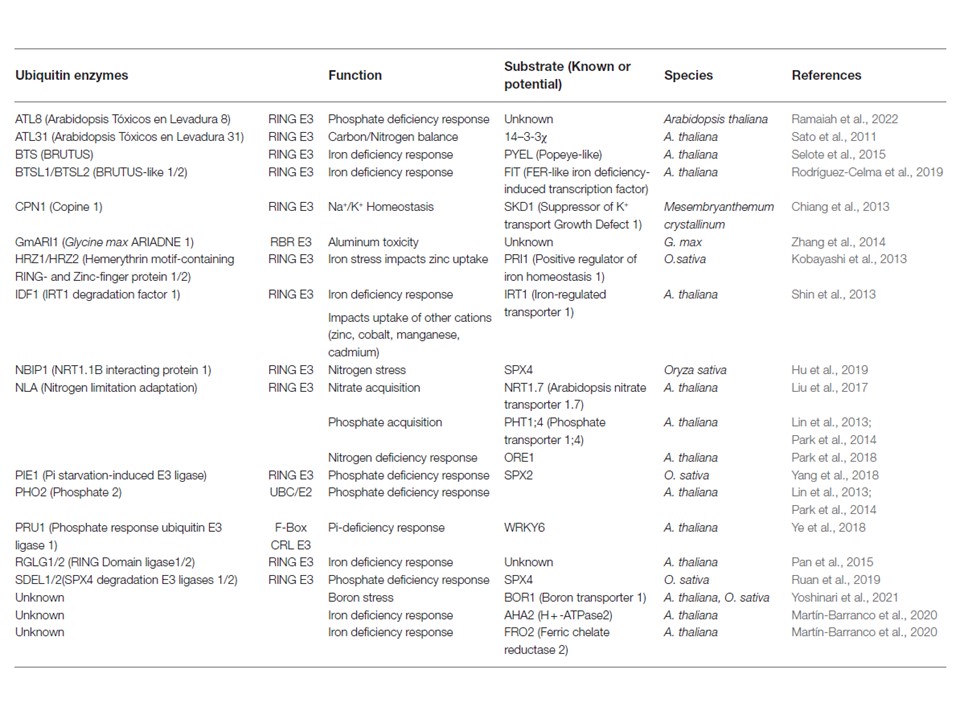
表1
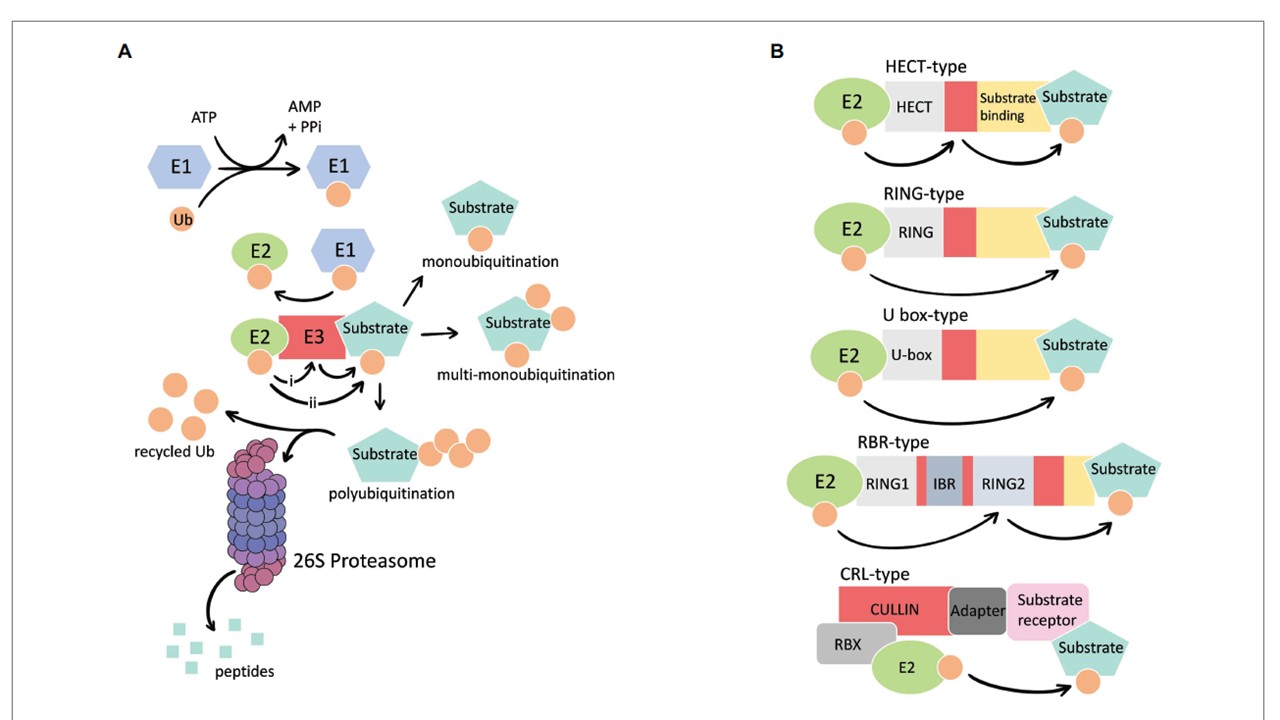
図1
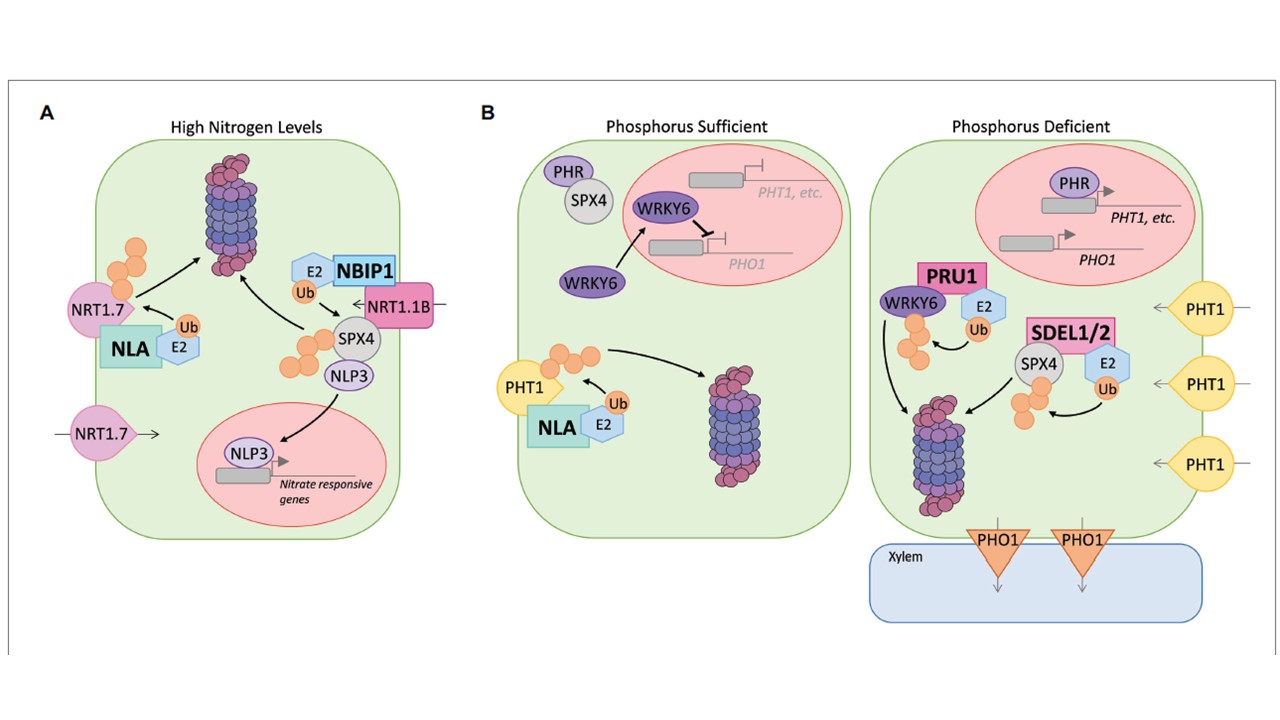
図2