シロイヌナズナBRUTUSおよびBRUTUS-LIKE2タンパク質のヘムエリスリン(:ヘメトリン)様ドメインの鉄感知および酸化還元特性
以下の論文は、鉄系の論文で小生にとって初めてAIであるAlphaFold2予測が行われた論文として印象深いものである。
シロイヌナズナBRUTUSおよびBRUTUS-LIKE2タンパク質のヘムエリスリン(:ヘメトリン)様ドメインの鉄感知および酸化還元特性
Iron-sensing and redox properties of the hemerythrin-like domains of Arabidopsis BRUTUS and BRUTUS-LIKE2 proteins
Jacob Pullin, Jorge Rodríguez-Celma, Julia E. A. Mundy, Dimitri A. Svistunenko, Justin M. Bradley, Marina Franceschetti, Nick E. Le Brun & Janneke Balk
Nature communications
https://doi.org/10.1038/s41467-025-58853-9
要旨
植物における鉄の取り込みは、シロイヌナズナのBRUTUS(BTS)に代表される、高度に保存されたヘメリトリン(Hr)E3ユビキチンリガーゼによって負に制御されている。生理学的研究から、これらはわかりにくい植物鉄センサーであることが示唆されており、生化学的証拠が不足している。ここでは、BTSとBTS-LIKE2(BTSL2)のN末端ドメインが、3つの密接に詰まったHr様サブドメイン内で、それぞれ3つと2つの二鉄センターと結合することを示す。BTSとBTS-LIKE2(BTSL2)のN末端ドメインはそれぞれ3個と2個の二鉄中心を3つの密接に詰まったHr様サブドメイン内に結合している。還元状態では、鉄の一部が不安定になる。これは、Fe2+キレーターへのアクセス性と再構成実験に基づくもので、動的な鉄結合と一致する。BTS dgl変異体における鉄結合の障害と酸化還元特性の変化は、下流のシグナル伝達カスケードを抑制する能力の低下と相関している。これらのデータは、BTS/Lsが植物界に特有の鉄センサーとしてどのように機能するかについてのメカニズムモデルの生化学的基盤を提供するものである。
まえがき
細胞や生物全体における鉄の濃度は、遊離鉄の酸化還元サイクル(フェントン化学)による毒性を回避しつつ、需要を満たすように厳密に制御されている。植物では、鉄の取り込みは特定のE3ユビキチン・タンパク質リガーゼによって負に制御されている。単子葉植物ではヘメリスリンRINGおよびジンクフィンガー(HRZ)タンパク質として知られ、双子葉植物ではBRUTUS(BTS)と名付けられた。関連するBTS-LIKE(BTSL)タンパク質は双子葉植物にのみ見られ、根における鉄の取り込みを制御する特異的な役割を持つ。イネHRZまたはシロイヌナズナBTS遺伝子の変異は、鉄の過剰蓄積をもたらし、ノックアウト対立遺伝子では胚致死を引き起こす。対照的に、BTSL1とBTSL2の両遺伝子の発現を欠くシロイヌナズナは生存可能であり、特定の生育条件下で中程度の量の鉄を蓄積する。
HRZ/BTSタンパク質は比較的大きく(〜140kDa)、N末端の連続したヘメリトリン様配列とC末端のRING型ユビキチンリガーゼドメインからなる(図1)。ヘメリトリンは、その名前とは裏腹に、ヘムではなく、通常は鉄である一対の陽イオンと結合し、金属結合性のHis残基とGlu残基のパターンに基づいて、標準的なO2担体ヘメリトリンとヘメリトリン(Hr)様タンパク質に分類される。HRZ/BTSのE3リガーゼドメインは、鉄欠乏応答を制御する転写因子と相互作用し、それらを分解に導く(総説は文献1にある)。Hr様配列とE3リガーゼの組み合わせは、哺乳類のF-box/LRR-repeatタンパク質5 (FBXL5)にも見られ、N末端に1つのHr様配列を持ち、C末端にCullin型E3リガーゼのサブユニットを持つ。鉄と酸素の存在下で、FBXL5は鉄調節タンパク質2(IRP2)との相互作用を促進し、その後IRP2のユビキチン化と分解を行う。これに類似して、HRZ/BTSのHr様ドメインも鉄や酸素を感知することが提唱されているが、生化学的な研究はこれまで報告されていない。さらに、なぜ3つのHr様配列があるのか、酸化還元活性がユビキチンリガーゼ活性にどのように影響しうるのかは未解決の問題である。ここでは、シロイヌナズナのBTSとBTSL2の組換え発現Hr様ドメインの構造、鉄結合特性、酸化還元活性について報告する。小角X線散乱解析の結果、3つのHr様フォールドが、AlphaFold2予測によって支持された、大きく剛直なドメインに密に配置されていることが予想外にも示された。様々な分光学的手法により、BTSとBTSL2はそれぞれ3つと2つの二鉄中心と結合することが示され、それらは酸化状態では強く結合しているが、還元状態では部分的に不安定であることがわかった。試験管内での鉄結合と酸化活性の障害は、生体内でのBTSの活性低下と相関していた。これらのデータは、ユニークなトリプルHr様ドメインに存在する二鉄中心によるBTS/Lタンパク質の鉄感知機構のモデルを示唆している。
以下は図の説明。図は10枚あるが紙面の関係上3枚のみ紹介した。しかし他の図も全部訳しておいた。
図1|HRZ/BTSタンパク質の保存されたドメイン構成と予測されるタンパク質フォールド。
a ヘメリトリン(Hr)様配列はH1、H2、H3と記した。濃い灰色は鉄結合リガンドの存在、薄い灰色は非存在を示す。クエスチョンマークは、6つのリガンドのうち1つが存在しないか、アラインメントされていないことを示す。完全な種名と配列IDについては、補足表1を参照。系統解析はwww.phylogeny.fr54。スケールバーは部位ごとのアミノ酸置換数を示す。
b BTSL2のAlphaFold2モデル。Hr様フォールドはH2-H1-H3が稠密に並んでいると予測される。
図2|BTSL2のN末端ドメインの小角散乱解析。
a 3つのHr様配列を包含するシロイヌナズナBTSL2 N末端(BTSL2-N、コドン1-831)の発現構築物、溶解性のためのマルトース結合タンパク質(MBP)とアフィニティー精製のためのC末端Strepタグで挟まれている。
b Strep-Tactin XTを用いて精製したMBP-BTSL2-N(左)と、プロテアーゼXa切断とサイズ排除クロマトグラフィーによりMBPドメインを除去したBTSL2-N(右)のクマシー染色SDS-PAGEゲル。画像は3回の実験の代表例。
c X線波長(Å-1)に逆相関する運動量移動変数qに対する強度I(q)の散乱プロファイル。
挿入図: ln(I)をq2に対してプロットしたGuinier解析。グラフの傾きから33.95±0.05Åの回転半径Rgが計算された(R2=0.9941)。ゼロ角での強度I(0)は0.062cm-1±0.000096であり、残差は均一な分布を示した。
d BTSL2-Nタンパク質エンベロープのモデルと、手動で挿入した二鉄中心を持つ改良AlphaFold2モデルを重ねたもの。SAXS実験データと解析の要約は補足データ1を参照。ソースデータはwww.sasbdb.org のアクセッションSASDU79に寄託されている。
図3|BTSL2とBTSのHr様ドメイン内の鉄補因子。
a 鉄の定量と分光に用いたシロイヌナズナBTSL2とBTSのN末端配列のMBP融合タンパク質の図。BTSL2のE98残基とE664残基を示す。 b MBPドメイン(ラベルは省略)を含む示された精製タンパク質のクマシー染色SDS-PAGEゲル、1レーンあたり5µgタンパク質。結果は(c)に示した調製数の代表値。
図4|BTSL2とBTSのHr様ドメインはO2とH2O2で酸化還元活性を示す。(a,b)BTSL2-Nおよび(d,e)BTS-N(MBP融合タンパク質、図3参照)のUV-可視吸光度分光法による酸化還元滴定。黒線:空気中で精製した「分離したままの」タンパク質(a, d)または滴定の終点(b, e)。灰色線:嫌気チャンバー内で亜ジチオン酸で完全に還元し、脱塩したもの。c, f BTSL2-については(a, b)のスペクトル、BTS-Nについては(d, e)のスペクトルに基づく、酸化剤対鉄比の関数としての359nmの吸光度の差。
図5|電子常磁性共鳴(EPR)によるBTSL2およびBTSのHr様ドメインにおけるタンパク質結合鉄の解析。(a)BTSL2-Nと(b)BTS-NのEPRスペクトル。タンパク質ドメインはMBP融合タンパク質として発現させた(図3a参照)。
g値4.3のシグナルは単核鉄であり、g値1.9前後のシグナルは混合価Fe2+/Fe3+中心の特徴である。両シグナルとも、タンパク質に結合した鉄の1%を表している。なぜなら、ジ鉄中心の大部分は、完全に酸化または還元された状態ではEPRサイレントだからである。黒: 単離されたBTSL2-N(287µM)とBTS-N(222µM)タンパク質。灰色:亜ジチオン酸塩で還元し、嫌気チャンバーで脱塩したBTSL2-N(130µM)とBTS-N(100µM)。青色: BTSL2-N(106µM)およびBTS-N(84µM)3mを、それぞれ216µMおよび262µM O2濃度の過飽和O2溶液と混合したもの。赤色: BTSL-N(106µM)およびBTS-N(84µM)を、それぞれ216µMおよび262µMのH2O2と混合してから3分後。試薬の添加と脱塩による希釈を補正するためにスペクトルを調整した。EPRスペクトルは、次のパラメーターを用いて10Kで記録した:マイクロ波周波数vMW=9.353GHz、変調周波数vM=100kHz、マイクロ波パワーPMW=3.17mW、変調振幅AM=5G。 この結果は、2つの独立したタンパク質調製の代表値です。
図6|Hr様ドメインへの鉄結合は酸化状態に依存する。
a-d比色鉄キレーターFereneを用いてモニターしたタンパク質結合鉄の放出。経時的な吸光度は、タンパク質から放出された鉄の量と相関している。独立した時間経過測定のトレースが重なっている。単離したままの」タンパク質は主に酸化型であるが、BTSを安定化させるためにβ-メルカプトエタノール(BME)が残留している。BTSL2-Nについては、BMEなしで単離されたタンパク質も示されている。タンパク質はMBP融合体として産生され(図3参照)、亜ジチオン酸塩とのインキュベーション後に還元され、脱塩された。 a BTSL2-N; (b) BTSL2-N E98A; (c) BTSL2-N E664A; (d)BTS-N.
図7| BTSL2-Nは鉄を部分的に除去した後でも完全に再構成できる。
a 最初に不安定鉄を除去し、次にタンパク質に結合した鉄のみを検出するCDスペクトルでモニターした二鉄中心を再構成する実験手順の図。
b 精製MBP-BTSL2-N (86µM)を単離した状態(黒)と、亜ジチオン酸塩で還元した後、脱塩して除去した状態(灰色)のCDスペクトル。還元されたタンパク質は、タンパク質に結合した鉄の40%が除去されるように計算された規定量のフェレンと混合された。試料の半分を脱塩してFe2+キレーター種を除去し、O2(水色)に晒してタンパク質結合鉄の部分的除去を示した。残りの半分は、3倍過剰の硫酸第一鉄アンモニウムと混合し、脱塩して結合していない鉄を除去し、タンパク質を還元状態に保った(紫)。試薬の添加と脱塩による希釈のため、スペクトルをオンペンスに調整した。結果は2つの独立した実験の代表値である。
図8|H1への鉄結合の欠如は、生体内での二鉄中心の酸化とBTSの活性に影響する。
a BTSのdgl変異体タンパク質における5アミノ酸欠失の位置の図。エンドウ豆32のBTSホモログで同定された、鉄ホメオスタシスの誤った制御を引き起こす変異を、N末端ドメイン(BTS-N)のシロイヌナズナ(At)発現コンストラクトで再構築した。欠失は、太字で示した鉄結合リガンドの2つ、H173とE177に隣接している。
b BTS-N(2.5µg)とBTS dgl-N(5µg)のdg lvariant proteをクマシー染色したSDS-PAGEゲルで精製し、MBP融合タンパク質として大腸菌で生産した。実験的に決定された鉄:タンパク質比は、BTSdgl-Nで4±0.18であった。
c 比較のために、BTS dgl-N(青斜線)とBTS-N(赤斜線、図3dより)のUV可視分光法でモニターした酸化還元反応。単離したままのロテイン(実線)を亜ジチオン酸で還元し(点線)、50分間空気にさらすことで再酸化した(破線)。BTSdgl-Nの鉄:タンパク質比とスペクトルは、2つの独立したタンパク質精製の代表値である。
図9|BTS/Lタンパク質が鉄結合と酸化によって活性化されるメカニズムの提案。還元的な細胞環境では、鉄結合は動的であり、細胞内の鉄濃度が高くなるにつれて、二鉄中心は完全に占有されるようになる。二鉄中心の酸化は鉄の結合親和性を増加させ、補酵素を所定の位置に固定し、おそらく構造変化を通してE3ユビキチンリガーゼの活性化につながる。ここに描かれているのは3つの二鉄中心を持つBTSのモデルであり、BTSL2ではH2二鉄中心は存在しない。Fe2+とFe3+はそれぞれ薄茶色と濃い茶色の球で示されている。
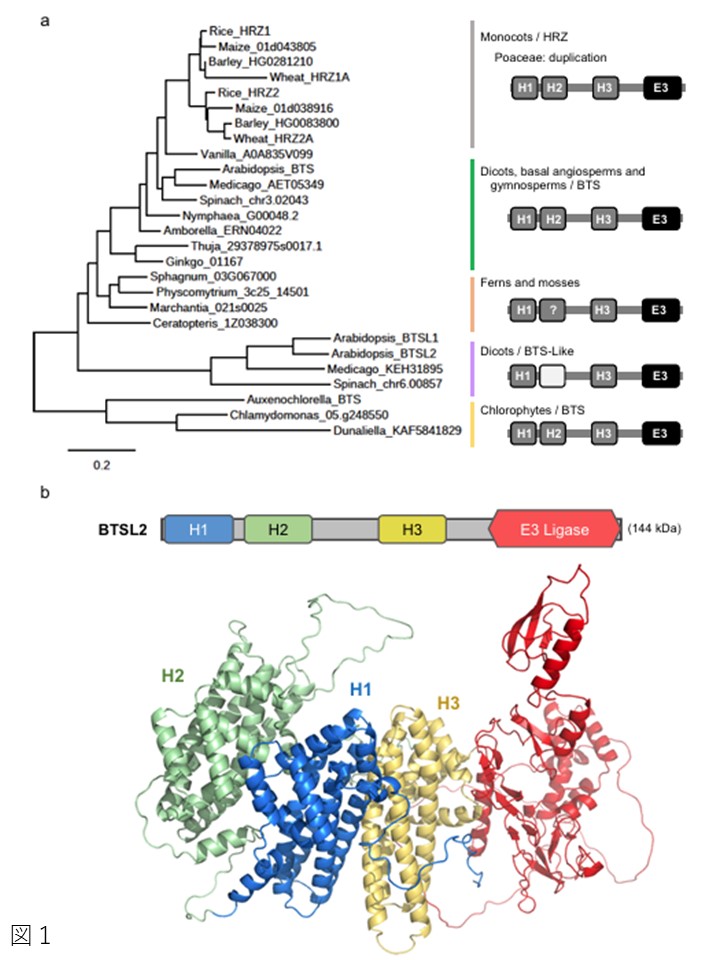
図1
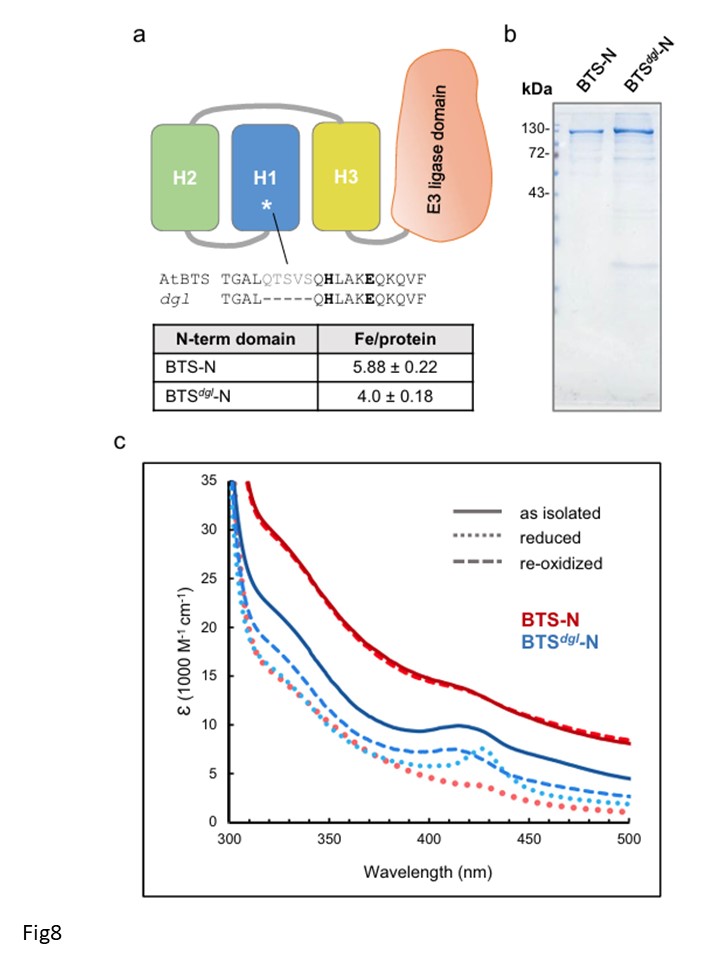
図8
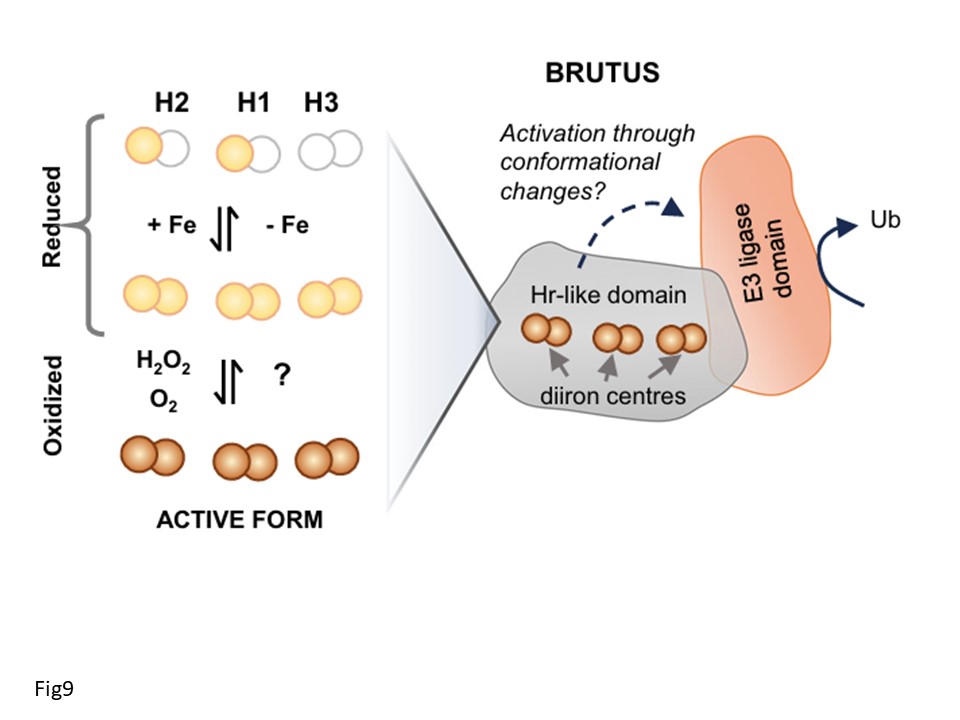
図9